癌症治疗中,化疗因缺乏精准性存在明显副作用。尽管纳米药物递送系统有望提升靶向性,但实现药物在肿瘤部位长效驻留仍是难题。东南大学生物科学与医学工程学院、数字医学工程全国重点实验室的梁高林教授、王睿研究员团队创新研发"释放与捕获"递送策略,通过精准药物定位技术为化疗带来突破性进展。

为了提升化疗药物的靶向性,过去二十年里,科研人员研发出许多基于纳米载体的药物递送系统,试图给化疗药物装上“智能导航”,使其能精准抵达肿瘤病灶。传统的纳米载体由于自身尺寸的限制,携带“导航信号”的能力十分有限。且在肿瘤微环境中还会受酸性条件等因素影响,导致药物提前释放,大大降低了治疗效果,甚至还可能引发全身毒性。东南大学科研团队另辟蹊径,提出“释放与捕获”新型药物递送策略,成功研发出“装载喜树碱多肽前药的壳聚糖硅球复合物”,在癌症化疗中开辟了新路径。

东南大学首席教授、生物科学与医学工程学院博导梁高林告诉记者:“我们故意把它做成水溶性,它是一个透明的液体,现在可以注射,利用癌细胞的磷酸酯酶,把磷酸根拔掉,就变成两亲性,两亲性就排队,排队就形成这种水凝胶。所以让它在癌细胞表面膜上、细胞膜上排队,不让它跑走,这是我们最大的创新。”

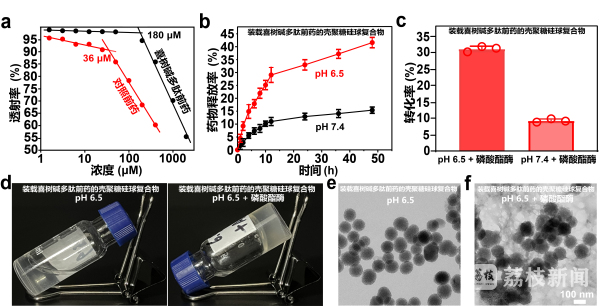
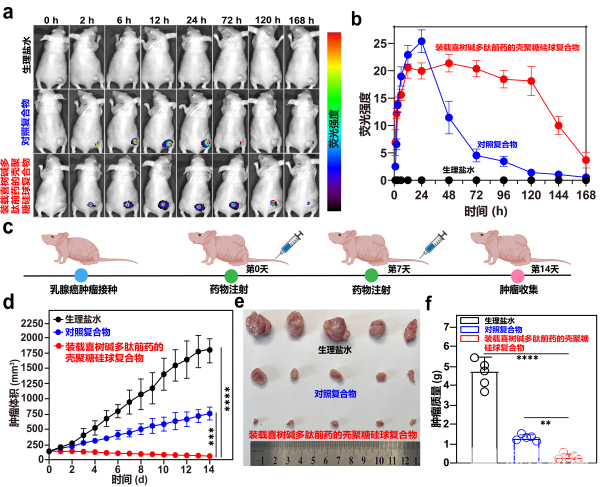
据介绍,这种纳米药物的工作机制十分巧妙,就像一场精心策划的“战斗”。该纳米药物通过血液循环富集到肿瘤部位,肿瘤的微酸性环境触发纳米载体释放前药分子,在癌细胞膜表面构建起一层水凝胶,纳米载体被牢牢地“捕获”在癌细胞膜上,剩余的前药分子从纳米载体中持续缓慢释放,逐渐“进击”癌细胞内部。在癌细胞内,前药在细胞内羧酸酯酶的作用下,分解释放出活性化疗药物喜树碱,精准地对癌细胞发起攻击,从而提高癌症化疗的靶向效率。目前,在小鼠乳腺癌模型实验中,“装载喜树碱多肽前药的壳聚糖硅球复合物”能够有效靶向肿瘤并长时间滞留,显著抑制了肿瘤生长,大幅提升了化疗效果。

东南大学生物科学与医学工程学院研究员王睿说:“一般来说,传统的纳米药物它效率大概是1%以下,我们现在可以把药物利用度提高到5%~15%,目前是在小鼠层面得到了非常好的一个验证,后面我们还是需要把它进一步往临床上面推,这个需要我们在材料的设计,还有更大模型动物的一个验证,都是需要做很多工作的。”
展望未来,随着技术的不断优化与验证,“装载喜树碱多肽前药的壳聚糖硅球复合物”有望进入临床试验阶段,为多种类型的肿瘤,尤其是难以手术切除的转移性肿瘤,量身定制更为高效、个性化的治疗方案,还有望推动其它领域的药物递送系统发展,如抗感染、心血管疾病等的精准治疗。
(来源:江苏广电总台·荔枝新闻中心 记者/黄迪 史斌燕 通讯员/吴涵玉 编辑/李国政)
原文网址:
https://m.jstv.com/news/2025/4/8/1359110805163102208.html?curchannel=%E7%8E%B0%E5%9C%BA




